lalalalalalalala
Nomenclatura del Ácido Carboxílico
junio 22, 2009 a 5:48 am (Ácido Carboxílico)
Los nombres de los ácidos carboxílicos se designan según la fuente natural de la que inicialmente se aislaron. Se clasificaron así:
|
Nombres y fuentes naturales de los ácidos carboxílicos |
|||
|
Estructura |
Nombre IUPAC |
Nombre común |
Fuente natural |
| HCOOH | Ácido metanoico | Ácido fórmico | Destilación destructiva de hormigas (formica en latín) |
| CH3COOH | Ácido etanoico | Ácido acético | Fermentación del vino |
| CH3CH2COOH | Ácido propanoico | Ácido propiónico | Fermentación de lácteos (pion en griego) |
| CH3CH2CH2COOH | Ácido butanoico | Ácido butírico | Mantequilla (butyrum, en latín) |
| CH3(CH2)3COOH | Ácido pentanoico | Ácido valérico | Raíz de la valeriana officinalis |
| CH3(CH2)4COOH | Ácido hexanoico | Ácido caproico | Dolor de cabeza |
Obtención de un Ácido Carboxílico
junio 22, 2009 a 5:45 am (Ácido Carboxílico)
PARA OBTENER UN ACIDO CARBOXILICO R1-COOH, DONDE R1 = RESTO ALQUILO RAMIFICADO TERCIARIO, O BIEN RESTO CICLOALQUILO DE UNO O VARIOS CICLOS AL TRESBOLILLO O NO, Y EVENTUALMENTE SUSTITUIDO POR LO MENOS POR UN RESTO ALQUILO, SIENDO EL ATOMO DE C EN (ALFA) DEL GRUPO CARBONILO UN ATOMO DE C TERCIARIO, SE HACE REACCIONAR, EN PRESENCIA DE UN ACIDO COMO CATALIZADOR, UN ALCANO RAMIFICADO O CICLICO R1H, CON R1 = RESTO ALQUILO RAMIFICADO O BIEN RESTO CICLOALQUILO DE UNO O VARIOS CICLOS AL TRESBOLILLO O NO, Y EVENTUALMENTE SUSTITUIDO POR UN RESTO ALQUILO POR LO MENOS, SIENDO EL ATOMO DE C EN (ALFA) DEL ATOMO DE HIDROGENO UN ATOMO DE CARBONO TERCIARIO O UN ATOMO DE C SECUNDARIO CAPAZ DE REAGRUPARSE EN EL CURSO DE LA REACCION A ATOMO TERCIARIO, CON UN FORMIATO H(CO)O(CR2R3R4), R2, R3 Y R4 = H O ALQUILO, CON LA TRIPLE CONDICION DE QUE R2, R3 Y R4 NO SEAN SIMULTANEAMENTE H, QUE EL FORMIATO CONDUZCA EN EL MEDIO REACTIVO, DIRECTAMENTE, O DESPUES DE UN REAGRUPAMIENTO, A UN CATION R2R3R4C+ ESTABLE, Y QUE EL ALCANO R2R3R4CH QUE SE FORMA SE PUEDA ELIMINAR COMODAMENTE DEL MEDIO DE REACCION.
Propiedades Físicas y Químicas de los Ácidos Carboxílicos
junio 22, 2009 a 5:06 am (Ácido Carboxílico)
Propiedades Físicas
Los ácidos de masa molar baja (hasta diez átomos de carbono) son líquidos incoloros, de olor muy desagradable. El olor del vinagre se debe al ácido acético; el de la mantequilla rancia al ácido butírico. El ácido caproico se encuentra en el pelo y secreciones del ganado caprino. Los ácidos C5 a C10 poseen olores a “cabra”. El resto sólidos cerosos e inodoros a temperatura ambiente. Sus puntos de fusión y ebullición crecen al aumentar la masa molar.
Los ácidos inferiores son solubles en agua; su solubilidad decrece a partir del ácido butírico con el aumento del carácter hidrocarbonado de la molécula. Todos los ácidos son solubles en solventes orgánicos.
Utilidad del Ácido Carboxílico
junio 22, 2009 a 5:02 am (Ácido Carboxílico)
Aplicaciones Industriales
Los ácidos carboxílicos de mayor aplicación industrial son el ácido acético que se utiliza fundamentalmente para la obtención de acetato de vinilo que se utiliza como monómero para la fabricación de polímeros. También se utiliza en la producción de acetato de celulosa para la obtención de lacas y películas fotográficas, así como en la fabricación de disolventes de resinas y lacas. La sal alumínica del ácido acético se emplea como mordiente en tintorería.
El ácido fórmico se suele emplear en la industria del curtido al objeto de suavizar las pieles y también en los procesos de tintorería en la industria del curtido. Algunos derivados clorados de los ácidos carboxílicos se emplean en la producción de herbicidas.
El ácido benzoico tiene una amplia utilidad como intermediario de síntesis en muchos procesos orgánicos y algunos de sus ésteres se emplean como plastificantes y en la industria de la perfumería (benzoato de bencilo). El benzoato de sodio se emplea en la industria de la alimentación como conservante (zumos, refrescos, mermeladas, etc.).
Entre los ácidos dicarboxílicos, el ácido propanodioico (ácido malónico) se emplea en la elaboración de medicamentos, plaguicidas y colorantes. El ácido 1-4-butanodioico (ácido succínico) se emplea en la obtención de resinas de poliéster para barnices y el ácido trans-butenodioico (ácido fumárico) se emplea como acidulante en la fabricación de refrescos.
Nomenclatura de los Ésteres
junio 20, 2009 a 6:23 am (Ésteres)
Éster como grupo funcional
Se termina el nombre del alcano en -ato de alquilo. Cuando va unido a un ciclo el grupo éster se nombra como -carboxilato de alquilo

Éster como sustituyente
Cuando en la molécula existe un ácido carboxílico, el éster pasa a ser un mero sustituyente y se ordena por orden alfabético con el resto de sustituyentes de la molécula denominándose alcoxicarbonil.

Obtención de los Ésteres
junio 20, 2009 a 6:21 am (Ésteres)
- Cuando se hace reaccionar un ácido carboxilo con un alcohol obtienes un éster y además se libera una molécula de agua, es decir:
R – COOH + R’ – OH —–> R – COOR’ + H2O
Un ejemplo:
CH3COOH (ácido) + CH3OH —–> CH3COOCH3 + H2O
Lo que en palabras es lo siguiente:
Ácido etanoíco + metanol —–> Etanoato de metilo
Ø Esta es la escarificación de fisher : que es a partir de un ácido carboxilico y un alcohol:
RCOOH + ROH ——— RCOOR + H2O
otros métodos de obtención de esteres son:
RCOOH + CH2N2 ———– RCOOCH3 + N2
RCOO-Na+ + RX —————–RCOOR + NaX
(sal) (haluro de alquilo) (éster) (haluro de sodio) donde X puede ser : F,I,Cl
Propiedades Físicas y Químicas de los Ésteres
junio 20, 2009 a 6:19 am (Ésteres)
PROPIEDADES FISICAS:
Al tratarse de compuestos moleculares (líquidos volátiles o sólidos) sus propiedades físicas más representativas son:
- Aislantes eléctricos en fusión y en disolución.
- Bajo temperatura de fusión y ebullición que crece con la masa molar. Las propiedades físicas y químicas de los ésteres de bajo peso molecular corresponden, en general, a una combinación de las propiedades de los dos grupos. Al aumentar el peso molecular, la parte de hidrocarburo de la molécula tiene un efecto preponderante sobre las funciones oxigenadas, razón por la cual los ésteres superiores son ceras sólidas, blandas e insolubles en agua.
- Según la longitud de la cadena hidrocarbonada serán más o menos solubles en agua y más o menos solubles en disolventes orgánicos (hexano, éter, benceno, acetona…)
- A causa del número extraordinariamente elevado de ácidos y alcoholes que pueden utilitzarse en la reacción de esterificación, se han preparado y estudiado miles de ésteres, desde el más sencillo (HCOOCH3, formiato de metilo), hasta los compuestos de peso molecular más elevado que contienen 30 o más átomos de carbono en ambas partes de la molécula.
PROPIEDADES QUIMICAS:
- En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados.
- La saponificación de los ésteres, llamada así por su analogía con la formación de jabones a partir de las grasas, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas.
Utilidad de los Ésteres
junio 20, 2009 a 6:16 am (Ésteres)
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
- Butanoato de metilo: olor a Piña
- Salicilato de metilo (aceite de siempreverde): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
- Octanoato de heptilo: olor a frambuesa
- Etanoato de pentilo: olor a plátano
- Pentanoato de pentilo: olor a manzana
- Butanoato de pentilo: olor a pera o a albaricoque
- Etanoato de octilo: olor a naranja.
En general los esteres, son líquidos, son buenos disolventes por esa razón son usados en la preparación de barnices y lacas.
El proceso de obtenciòn de un ester, se denomina esterificaciòn y en este caso tambien se utiliza para obtener velas.
Nomenclatura de los Éteres
junio 20, 2009 a 6:12 am (Éteres)
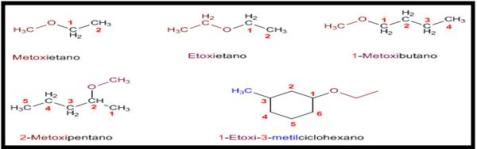
- Los éteres pueden nombrarse como alcoxi derivados de alcanos (nomenclatura IUPAC sustitutiva). Se toma como cadena principal la de mayor longitud y se nombra el alcóxido como un sustituyente.
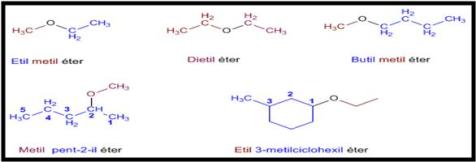
- La nomenclatura funcional (IUPAC) nombra los éteres como derivados de dos grupos alquilo, ordenados alfabéticamente, terminando el nombre en la palabra éter.
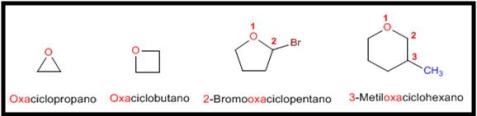
- Los éteres cíclicos se forman sustituyendo un -CH2– por -O- en un ciclo. La numeración comienza en el oxígeno y se nombran con el prefio oxa- seguido del nombre del ciclo.